2022年11月5日-6日,由北京藥學(xué)會主辦,藥物臨床評價專委會承辦的“藥物臨床試驗質(zhì)量管理規(guī)范法規(guī)與實踐”培訓(xùn)班通過北京藥學(xué)會在線管理平臺成功舉辦。本次培訓(xùn)面向北京市臨床試驗相關(guān)管理、實踐人員,同時也吸引了其他省(市)的行業(yè)同仁積極參加培訓(xùn),累計3844人次觀看。
北京藥學(xué)會崔一民副理事長進(jìn)行開班致辭,他指出新版的《藥物臨床試驗質(zhì)量管理規(guī)范》于2020年7月1日正式施行,新版GCP的實施為深化藥品監(jiān)管改革,鼓勵創(chuàng)新,推動我國臨床試驗科學(xué)化、國際化和規(guī)范化工作起到了積極作用,希望通過培訓(xùn)共同探討臨床試驗管理實踐中存在的新問題,共同提高臨床試驗質(zhì)量。他同時強調(diào),黨的二十大報告對保障人民健康、深化醫(yī)藥衛(wèi)生體制改革、強化藥品安全監(jiān)管等作出了一系列重大論述和重大部署,充分體現(xiàn)了黨對藥品安全的高度重視,希望所有醫(yī)藥行業(yè)從業(yè)者在工作中學(xué)習(xí)貫徹黨的二十大精神,順應(yīng)形勢、抓住機遇,把學(xué)到的理論、方法、經(jīng)驗應(yīng)用到臨床試驗管理實踐中去,努力做好臨床試驗管理相關(guān)服務(wù)。
(崔一民副理事長致辭)
培訓(xùn)分兩天進(jìn)行。11月5日的課程由藥物臨床評價專委會副主任委員北京市藥品審評中心于磊教授、藥物臨床評價專委會副主任委員北京醫(yī)院李可欣教授分別擔(dān)任主持。北京大學(xué)臨床藥理研究所崔一民教授、北京市藥品審評中心于磊教授、北京同仁醫(yī)院趙秀麗教授、北京積水潭醫(yī)院王美霞教授、北京友誼醫(yī)院董瑞華研究員和北京醫(yī)院薛薇教授進(jìn)行了“我國創(chuàng)新藥物研發(fā)相關(guān)問題思考”、“藥物臨床試驗相關(guān)法規(guī)介紹和現(xiàn)場核查要點”、“合格研究者應(yīng)具備要素”、“受試者權(quán)益保護(hù)”、“研究型病房建設(shè)”和“研究者視角下臨床試驗期間的風(fēng)險管理”等內(nèi)容的授課。
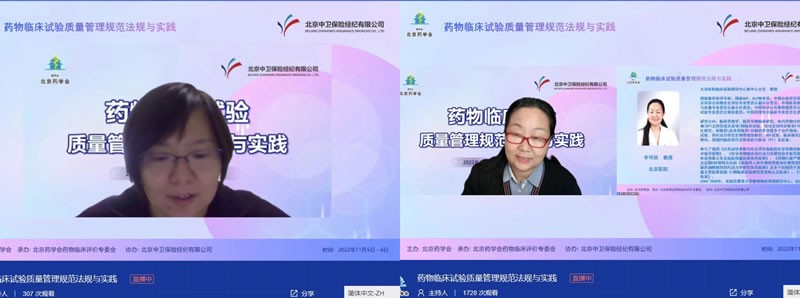
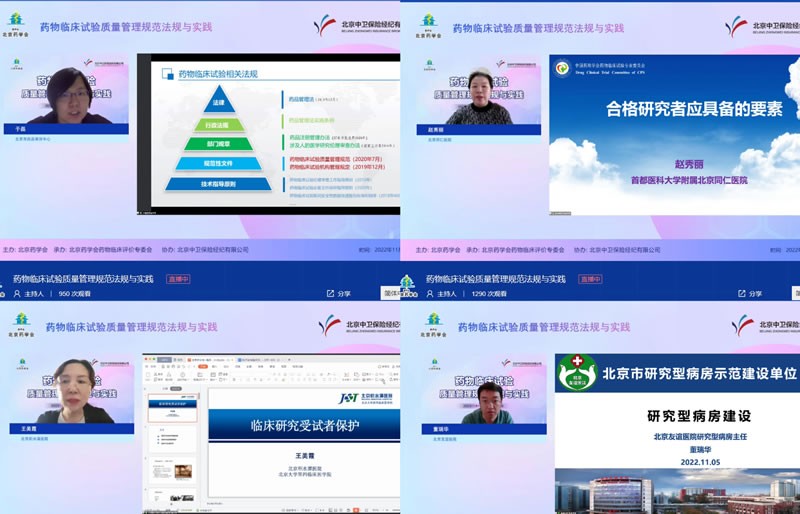
(會議主持及講者)
11月6日的課程由藥物臨床評價專委會副主任委員北京中衛(wèi)保險經(jīng)紀(jì)有限公司總經(jīng)理曹麗君和北京大學(xué)第一醫(yī)院梁雁教授分別擔(dān)任主持。清華長庚醫(yī)院陳曉媛教授、北京朝陽醫(yī)院王淑民教授、北京法瑪唯謹(jǐn)醫(yī)藥科技有限公司程剛總經(jīng)理、中國藥科大學(xué)基礎(chǔ)醫(yī)學(xué)與臨床藥學(xué)學(xué)院于鋒教授、北京大學(xué)臨床藥理研究所魏敏吉教授和北京大學(xué)第一醫(yī)院許俊羽教授進(jìn)行了“中國抗腫瘤藥創(chuàng)新趨勢分析”、“臨床試驗質(zhì)量管理體系的建設(shè)”、“臨床試驗期間的藥物警戒”、“藥物研發(fā)過程GCP和臨床研究團(tuán)隊的角色和職責(zé)”、“ICH Efficacy Guidelines介紹”和“臨床試驗倫理審查要點”等內(nèi)容的授課。北京大學(xué)第一醫(yī)院梁雁教授對培訓(xùn)班進(jìn)行了總結(jié)。
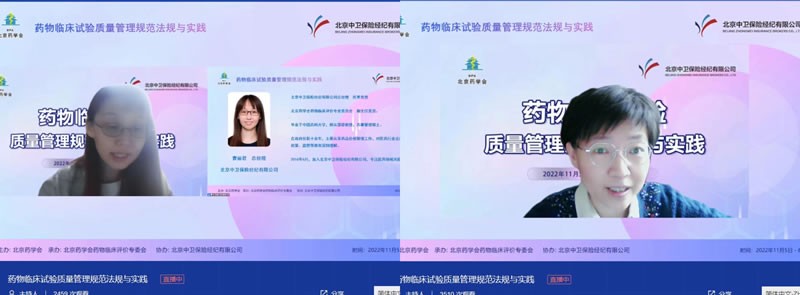
(會議主持及講者)
本次培訓(xùn)緊貼行業(yè)熱點,回應(yīng)行業(yè)關(guān)切,培訓(xùn)內(nèi)容系統(tǒng)全面,實用性強,為進(jìn)一步提高北京地區(qū)醫(yī)療機構(gòu)臨床試驗的理論水平和實踐水平起到了積極作用。
藥物臨床評價專委會供稿
2022年11月7日
北京藥學(xué)會 地址:北京市朝陽區(qū)北三環(huán)中路2號小二樓2層
本網(wǎng)站瀏覽46492453次
Copyright 2012 北京藥學(xué)會( 本網(wǎng)站所有內(nèi)容未經(jīng)許可,不得以任何形式進(jìn)行轉(zhuǎn)載 ) All Rights Reservered