11月18日,CFDA公布《關于開展仿制藥質量和療效一致性評價的意見(征求意見稿)》(下稱意見稿),討論多年的仿制藥品一致性評價工作,終于迎來突破性進展。
通過一致性評價有什么優勢?
《意見稿》明確了評價對象和時限,加快了一致性評價的速度。在規定期限內未通過質量一致性評價的仿制藥,不予再注冊;通過質量一致性評價的,允許其在說明書和標簽上予以標注,并在臨床應用、招標采購、醫保報銷等方面給予支持。
根據以上內容,不用筆者多說,大家也能發現通過一致性評價的藥品,未來在市場、招標、銷售、醫保方面的多方面優勢。
1、 同品種市場競爭品牌減少
中國食品藥品檢定研究院副院長李波表示,準備用三年多的時間,在2018年底前,完成2007年10月1日前批準的國家基本藥物目錄中化學藥品仿制藥的口服固體制劑。據中檢院統計,上述品種總計300個,涉及17897個批準文號,涉及藥品生產企業1883家。
在懲戒措施上,力度也很大:
(1)對至2018年,基藥仿制口服固體未通過評價的,不得上市。
(2)其它品種,自首家品種通過評價后,其他同品種在3年內未通過評價的,不得上市。
(3)藥品批準文號有效期屆滿時仍未通過評價的,予以注銷。
(4)同一品種達到3家以上通過評價的,在招標采購,醫保報銷等方面不再選用未通過評價的品種。
有評論認為,一致性評價或將消滅三分之一的藥企。也就是說,通過一致性評價的藥品,將逐漸在市場中站穩腳步,并獲得相對優勢地位。
2、 藥品招標分組的優勢
目前,各省大標進展得如火如荼,相信大家也都發現,在各省標書中,通過一致性評價藥品的優勢了。
在今年年初國務院7號文中,明確要求“根據仿制藥質量一致性評價技術要求,科學設定競價分組”,而在各省新一輪采購方案中,大多數也確實體現了這一點。
最近公布藥品采購方案的省份,如山東、四川、黑龍江、廣西等,在競價分組中,都將“通過質量一致性評價的仿制藥”放在第一組,也就是第一質量層次,與原研、獲得國家科學技術獎藥品等同一競價組。
究竟有多少藥品做了一致性評價呢?
此前,對于國內藥企而言,會主動參與一致性評價的很少,畢竟沒有利益推動。而如今,在行業準入的要求和招標、醫保等政策利好的推動下,許多企業已經開始著手開展一致性評價的工作。但是,目前為止還沒有一個藥品被藥監局認定是通過了一致性評價。
2013年CFDA發布的《關于2013年度仿制藥質量一致性評價方法研究任務的通知》公布了75個產品的一致性評價品種名單和方法研究承擔單位匯總表。
而對于一致性評價工作,中國食品藥品檢定研究院此前已發布征求意見的產品有5個,分別為鹽酸氨溴索片、奈韋拉平片、頭孢呋辛酯片、酒石酸美托洛爾和鹽酸特拉唑嗪片。艾司唑侖片、利巴韋林膠囊、多潘立酮片、等12個產品還在研討會階段,還有58個產品進度未明。
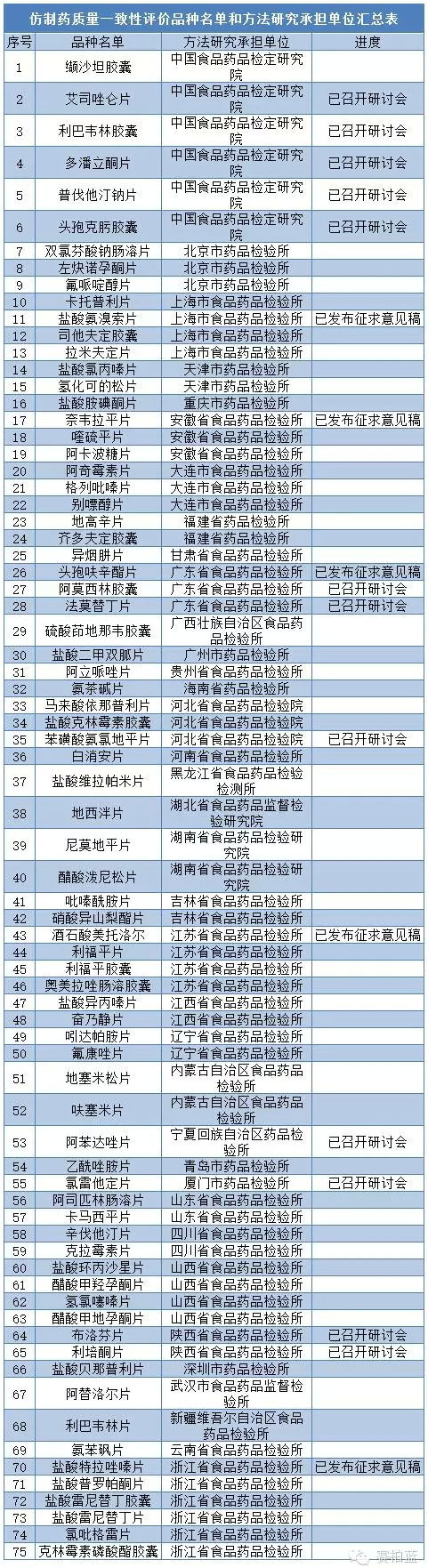
信息來源:中國食品藥品檢定研究院
www.PharmNet.com.cn 2015-11-23 賽柏藍
北京藥學會 地址:北京市朝陽區北三環中路2號小二樓2層
本網站瀏覽46616014次
Copyright 2012 北京藥學會( 本網站所有內容未經許可,不得以任何形式進行轉載 ) All Rights Reservered