覃魯珊1,2‡,趙海平1,2‡,趙艷玲1,馬致潔1,3,曾靈娜1,張雅銘1,張萍1,鄢丹1,柏兆方1,趙奎君3,王伽伯1*,肖小河1*
1 解放軍302醫(yī)院·全軍中醫(yī)藥研究所;2 江西中醫(yī)藥大學(xué);3 首都醫(yī)科大學(xué)附屬北京友誼醫(yī)院;
【摘要】 目的:比較大黃總蒽醌與總鞣質(zhì)提取物對(duì)肝臟的保護(hù)和損傷雙向作用。方法:同時(shí)采用正常和病理動(dòng)物(急性CCl4肝損傷模型),對(duì)比考察低、高劑量(5.40、14.69 g生藥/kg)的大黃總蒽醌與總鞣質(zhì)提取物連續(xù)灌胃6天對(duì)大鼠一般狀態(tài)、生化指標(biāo)和肝組織病理的影響。結(jié)果:大黃總蒽醌對(duì)正常動(dòng)物各生化指標(biāo)影響無(wú)明顯影響,且可以顯著降低肝損傷模型大鼠的血清丙氨酸氨基轉(zhuǎn)移酶(ALT)、天冬氨酸氨基轉(zhuǎn)氨酶(AST)、透明質(zhì)酸(HA)、轉(zhuǎn)化生長(zhǎng)因子-β1(TGF-β1),改善肝組織壞死,表明大黃蒽醌對(duì)肝損傷大鼠有保護(hù)作用。大黃總鞣質(zhì)高劑量組引起正常大鼠血清AST、ALT、HA顯著升高,病理切片可見肝細(xì)胞脂肪變性及小片狀膽汁淤積,表明大黃鞣質(zhì)對(duì)正常大鼠肝臟有損傷作用;大黃總鞣質(zhì)對(duì)模型大鼠AST、ALT有改善作用,但對(duì)HA、TGF-β1無(wú)改善作用,且觀察到肝組織纖維組織增生加重,表明大黃鞣質(zhì)加重了模型大鼠肝纖維化。結(jié)論:在相當(dāng)于藥材生藥量可比的劑量下,大黃蒽醌類成分對(duì)肝臟的保護(hù)作用顯著強(qiáng)于鞣質(zhì)類成分,而高劑量大黃鞣質(zhì)具有一定的肝損傷作用,提示大黃在臨床治療肝病時(shí)應(yīng)注意煎煮或提取方式,避免鞣質(zhì)類成分對(duì)療效的影響和潛在的肝毒性。
【關(guān)鍵詞】 大黃;蒽醌;鞣質(zhì);肝損傷;保護(hù);纖維化;因子分析
Bidirectional effects of the rhubarb anthraqenones and tannins to rat liver
QIN Lu-shan1,2, ZHAO Hai-ping1,2, ZHAO Yan-ling1, MA Zhi-jie1,3, ZENG Ling-na1, ZHANG Ya-ming1, ZHANG Ping1, YAN Dan1, BAI Zhao-fang1, ZHAO Kui-jun3, WANG Jia-bo1, XIAO Xiao-he1
1 China Military Institute of Chinese Medicine, 302 Military Hospital, Beijing (100039),China; 2 Jiangxi University of Traditional Chinese Medicine, Nanchang (330004),China; 3 Beijing Friendship Hospital, Capital Medical University, Beijing (100050),China
【Abstract】Objective : To comparatively investigate the bidirectional effects of the rhubarb anthraqenones and tannins to rat liver. Method: The total anthraquinone extract (TA) and total tannin extract (TT) of rhubarb were administrated to either normal or carbon tetrachloride(CCl4)-injured rats for 6 days at tow dosage levels ( 5.40 and 14.69 g·kg−1, counted as the quantity of crude material of rhubarb), followed by biochemical and histopathological tests of the rats' livers. Result: After administration of TA, no obvious injury was found in normal rats while protective effect to CCl4-treated rats was observed, with significant decline of values of serum alanine aminotransferase(ALT), aspartate aminotransferase(AST), hyaluronic acid (HA), transforming growth factor β1(TGF-β1) and improvement of hepatic necrosis in histopathology. By contrast, the administration of TT showed paradoxical effects to normal and CCl4-injured rats. In normal rats, TT induced significant increases of values of serum AST,ALT and HA as well histopathological changes including fatty denaturation of liver cells and cholestasis at the high dosage(14.69 g·kg−1). In CCl4-injured rats, TT revealed improvement to serum ALT and AST but not serum HA and TGF-β1, and aggravated the liver fibrosis. Conclusion: At equivalent dosage, the rhubarb anthraquinones had much greater liver protective effect than tannins. The total tannins of rhubarb had toxic effect to liver at high dosage. The results suggested that rhubarb should be used properly in decoction and extraction to reduce tannins and avoid its potential hepatotoxicity and impact to curative effect in clinics.
Keywords: rhubarb;anthraquinone;tannin;liver injury;protection;fibrosis;factor analysis
大黃是臨床常用的肝病治療中藥,具有清熱瀉火、利濕退黃、涼血解毒之功效[1],是肝病常用方藥茵陳蒿湯、大黃蟅蟲丸等的主要藥味。然而,近年來(lái)研究發(fā)現(xiàn)長(zhǎng)期、大劑量使用大黃可致肝、腎損害 [2-4],引起國(guó)內(nèi)外高度關(guān)注。筆者前期研究發(fā)現(xiàn),大黃在一定的劑量范圍內(nèi)對(duì)肝臟具有雙向作用,既可表現(xiàn)出對(duì)肝損傷動(dòng)物的治療作用,又可表現(xiàn)出對(duì)正常動(dòng)物的肝損傷作用。大黃中具有多種活性成分,主要包括蒽醌類和鞣質(zhì)類[5-6]。蒽醌在大黃藥材中含量在1.5%~4%左右,是藥典控制的指標(biāo)成分;鞣質(zhì)類成分在大黃中含量較高,可達(dá)5~15%。一般認(rèn)為蒽醌類成分具有保肝作用,但也有報(bào)道認(rèn)為蒽醌具有肝毒性。鞣質(zhì)的肝毒性尚不肯定,一般認(rèn)為可水解鞣質(zhì)的毒性高于縮合鞣質(zhì) [7-8]。大黃鞣質(zhì)主要為可水解鞣質(zhì),其是否具有肝毒性尚未見報(bào)道。大黃肝保護(hù)和肝損傷作用的物質(zhì)基礎(chǔ)有待科學(xué)闡明。
為此,本文將大黃蒽醌和鞣質(zhì)分離開來(lái),對(duì)比研究?jī)深惓煞址謩e對(duì)正常大鼠和肝損傷模型大鼠的作用規(guī)律,以期闡明大黃對(duì)肝臟保護(hù)和損傷作用的物質(zhì)歸屬。根據(jù)大黃蒽醌類成分極性較弱、易溶于乙醇等有機(jī)溶劑,鞣質(zhì)極性較強(qiáng)、易溶于水的性質(zhì)特點(diǎn),在闡明肝保護(hù)和肝損傷物質(zhì)歸屬的基礎(chǔ)上,可以通過(guò)選擇恰當(dāng)?shù)奶崛∪軇┖头绞教岣吲R床療效和避免肝臟不良反應(yīng)發(fā)生,促進(jìn)提高大黃臨床科學(xué)用藥水平。
1.材料與儀器
大黃藥材采自甘肅禮縣,經(jīng)解放軍第三〇二醫(yī)院肖小河研究員鑒定為蓼科植物掌葉大黃Rheum palmatum L.的干燥根及根莖。大黃總蒽醌和總鞣質(zhì)提取物由前期工作制備[9],按文獻(xiàn)方法檢測(cè)總蒽醌[10]和總鞣質(zhì)[11]含量,總蒽醌提取物中蒽醌含量56.73%、鞣質(zhì)含量1.78%,總鞣質(zhì)提取物中蒽醌含量0.83%、鞣質(zhì)含量38.26%,表明蒽醌和鞣質(zhì)得到較好分離。前期分析表明,大黃總鞣質(zhì)提取物主要含沒(méi)食子酸葡萄糖苷、兒茶素二聚體、沒(méi)食子酰兒茶素等可水解鞣質(zhì)衍生物[12];大黃總蒽醌提取物主要含大黃酸、大黃素、大黃酚、蘆薈大黃素、大黃素甲醚及其葡糖糖苷等,以及少量番瀉苷類成分[13]。
SD大鼠(SPF級(jí),6~8周齡,180±30g,♀♂各半)由中國(guó)人民解放軍軍事醫(yī)學(xué)科學(xué)院實(shí)驗(yàn)動(dòng)物中心提供[SCXK-(軍)2007-004]。CCl4(20060525,北京北化精細(xì)化學(xué)品有限責(zé)任公司);橄欖油(F20080219,國(guó)藥集團(tuán)化學(xué)試劑有限公司);TGF-β1試劑盒(090120,北京普爾偉業(yè)科技有限公司);其它試劑均為分析純。
Sn-69513型免疫計(jì)數(shù)器(上海核所日環(huán)光電儀器有限公司);2500 型超聲波清洗器 (江蘇省昆山市超聲儀器有限公司), 旋轉(zhuǎn)蒸發(fā)儀(德國(guó)Heidolph 公司), 全自動(dòng)生化分析儀 (OLYMPUS Au 800, 日本), 包埋機(jī)(AO,美國(guó)), 切片機(jī)(AO, 美國(guó)),光學(xué)顯微鏡 (Galen TMⅢ, 江南光學(xué)儀器廠),DT1000電子天平(中國(guó)輕工業(yè)機(jī)械總公司常熟衡器公司)。
2.實(shí)驗(yàn)方法
2.1 實(shí)驗(yàn)分組、造模及給藥
①分組 將動(dòng)物預(yù)養(yǎng)1周后,隨機(jī)分為10組,每組10只,♀♂各半:空白組(N)、模型組(M);空白組+大黃蒽醌低劑量組(NA1)、空白組+大黃蒽醌高劑量(NA2)、空白組+大黃鞣質(zhì)低劑量組(NT1)、空白組+大黃鞣質(zhì)高劑量組(NT2);模型組+大黃蒽醌低劑量組(MA1)、模型組+大黃蒽醌高劑組(MA2)、模型組+大黃鞣質(zhì)低劑量組(MT1)、模型組+大黃鞣質(zhì)高劑量組(MT2)。②造模 模型組在實(shí)驗(yàn)的第1天一次性腹腔注射含10% CCl4的橄欖油(2 ml•kg-1體重,現(xiàn)配現(xiàn)用)。③給藥 為了保證可比性,大黃總蒽醌和總鞣質(zhì)均以相當(dāng)于藥材生藥量給藥。前期研究大黃4個(gè)劑量(2、5.4、14.7、40 g生藥/kg體重)對(duì)正常和肝損傷大鼠的量-效/毒關(guān)系,發(fā)現(xiàn)5.4和14.7 g生藥/kg是大黃雙向作用劑量范圍[13],故本文以這兩個(gè)劑量進(jìn)行實(shí)驗(yàn)。各給藥組在造模第二天開始灌胃給藥,5 ml•kg-1體重,1 次/d,連續(xù)6 d;空白組與模型組灌胃平行給予同體積生理鹽水。
2.2 生化指標(biāo)測(cè)定
末次給藥前大鼠禁食不禁水18h,給藥1h后,股動(dòng)脈取血,離心后取血清,測(cè)定丙氨酸氨基轉(zhuǎn)移酶(alanine aminotransferase, ALT)、天冬氨酸氨基轉(zhuǎn)氨酶(aspartate aminotransferase, AST)、堿性磷酸酶(alkaline phosphatase, ALP)、透明質(zhì)酸(hyaluronic acid, HA)、總膽紅素(total bilirubin, TBIL)、γ-谷氨酰轉(zhuǎn)移酶(γ-glutamyltransferase, GGT)、總蛋白(total protein, TP)、白蛋白(albumin, ALB)、球蛋白(globulin, GLO)、白球蛋白(A/G)比值、尿素(carbamide,UREA)、層粘蛋白(laminin, LN)、層粘蛋白(laminin, LN)、尿素氮(urea nitrogen, BUN)、肌酐(creatinine, CREA)、轉(zhuǎn)化生長(zhǎng)因子-β1(transforming growth factor β1, TGF-β1)等。
2.3 組織病理檢測(cè)
實(shí)驗(yàn)結(jié)束后處死動(dòng)物,剖腹取肝臟,用冰生理鹽水清洗血跡,濾紙吸盡表面水分,精確稱重,然后切取左葉肝臟固定于10%福爾馬林液中常規(guī)脫水,石蠟包埋,5μm切片,采用HE常規(guī)染色,光鏡下觀察組織病理變化情況。
2.4 數(shù)據(jù)處理
實(shí)驗(yàn)數(shù)據(jù)以
3. 結(jié)果
3.1 動(dòng)物一般狀況變化
正常大鼠給予大黃總蒽醌提取物后出現(xiàn)了不同程度的排稀便,軟便,被毛臟亂、紅染,尿液棕黃色,低劑量組改變相對(duì)較輕;給予總鞣質(zhì)提取物的大鼠糞便相對(duì)較干燥,并隨給藥時(shí)間延長(zhǎng)大便逐漸呈灰暗色。各給藥組大鼠活動(dòng)狀態(tài)無(wú)顯著變化,體重隨劑量增加略有變化但無(wú)顯著性改變。
模型組大鼠以CCl4造模數(shù)天后,均表現(xiàn)出毛澤灰暗,飲食量減少,萎靡少動(dòng),抓持力弱,體重增長(zhǎng)緩慢等現(xiàn)象。模型大鼠給予總蒽醌提取物后出現(xiàn)不同程度的排稀便、軟便,被毛臟亂、紅染,尿液棕黃色;給予總鞣質(zhì)提取物的大鼠糞便干燥、顏色呈灰暗色,其中鞣質(zhì)高劑量組動(dòng)物體重恢復(fù)情況較差。
3.2 血清生化指標(biāo)變化
不同實(shí)驗(yàn)組大鼠顯著性變化的生化指標(biāo)見表1,其中只是列出一部分相關(guān)生化指標(biāo)。各正常動(dòng)物組在給藥第6天末,與空白組比較,NA2組動(dòng)物血清HA,NT2組動(dòng)物血清AST、ALT、HA具有明顯差異(P<0.05)。與NA2組比較,NT2組動(dòng)物血清AST明顯升高(P<0.05)。
各模型動(dòng)物組在給藥6天后,與N組比較,M組動(dòng)物血清AST、ALT、ALP、HA、LN、TGF-β1均顯著增高(P<0.05,P<0.01);與M組比較,MA1、MA2、MT1組動(dòng)物血清AST、ALT、HA、TGF-β1,MT2組動(dòng)物血清AST、ALT、ALP均顯著降低(P<0.05,P<0.01);與MT1組比較,MA1組動(dòng)物血清HA、TGF-β1降低明顯(P<0.05,P<0.01);與MT2組比較,MA2組動(dòng)物血清AST、HA、TGF-β1降低明顯(P<0.05,P<0.01)。
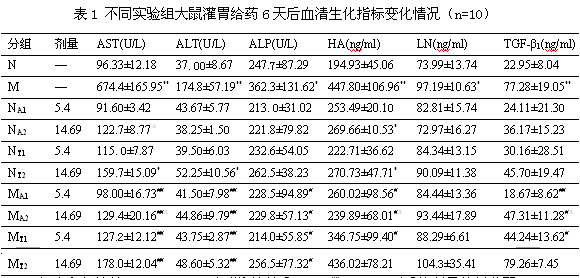
與空白組比較,*:P<0.05,**:P<0.01;與模型組比較,#:P<0.05;##:P<0.01;與同等劑量的總蒽醌給藥組比較,Δ:P<0.05;ΔΔ:P<0.01
3.3 肝組織病理變化
與N組比較,NA1組肝小葉結(jié)構(gòu)基本正常,部分肝細(xì)胞腫脹;NA2組肝小葉結(jié)構(gòu)基本正常,肝細(xì)胞核深染,胞漿嗜酸性染色,肝細(xì)胞輕度腫脹;NT1組部分肝細(xì)胞嗜酸性變,細(xì)胞核增大,深染,可見肝細(xì)胞點(diǎn)狀壞死;NT2組肝包膜附近可見小片狀膽汁淤積,肝細(xì)胞小片狀壞死,中央靜脈周圍肝細(xì)胞脂肪變性。
M組動(dòng)物可見肝細(xì)胞彌漫性水樣變性,部分肝組織大片狀壞死,肝包膜處肝細(xì)胞變性、壞死,包膜下可見纖維肉芽腫及多核巨細(xì)胞,匯管區(qū)及包膜可見纖維組織增生,部分腎曲管輕度腫脹、變性。于M組比較,MA1組肝細(xì)胞見散在的空泡變性;MA2組肝細(xì)胞輕度腫脹,偶見匯管區(qū)炎癥反應(yīng)及小膽管增生;MT1組肝實(shí)質(zhì)細(xì)胞可見散在小脂滴,部分肝細(xì)胞嗜酸性變,偶見小片狀肝壞死及炎癥細(xì)胞浸潤(rùn),可見多核巨細(xì)胞;MT2組可見肝包膜增厚,包膜下肝細(xì)胞變性,匯管區(qū)周圍肝細(xì)胞嗜酸性變性,部分肝細(xì)胞壞死,匯管區(qū)可見輕度的纖維組織增生。
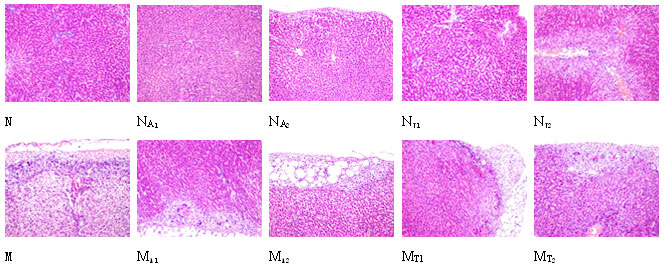
圖1 正常和肝損傷模型大鼠灌胃大黃總蒽醌和總鞣質(zhì)的肝臟病理切片照片HE×200
3.4 因子分析結(jié)果
針對(duì)上述給藥后變化明顯的6個(gè)生化指標(biāo),采用因子分析研究大黃蒽醌和鞣質(zhì)對(duì)肝臟的作用規(guī)律。因子分析模型的KMO(Kaiser-Meyer-Olkin)值大于0.5,Bartlett's檢驗(yàn)P值小于0.0001,證明所建數(shù)學(xué)模型滿足可靠性檢驗(yàn)要求。根據(jù)特征值大于1的判據(jù)[14],因子分析共提取到2個(gè)公因子,積累貢獻(xiàn)率86.1%,表明2個(gè)公因子代表了原始數(shù)據(jù)86.1%的信息,因子載荷、特征值及積累貢獻(xiàn)率見表2。以因子載荷大于0.5為顯著性判據(jù),公因子1主要由TGF-β1、HA、LN決定;公因子2主要由AST、ALT、ALP決定。HA和LN是肝細(xì)胞外基質(zhì)代謝過(guò)程中的產(chǎn)物,是肝纖維化和基質(zhì)沉積相關(guān)的直接指標(biāo)[15],TGF-β1水平可反映慢性肝病纖維化中組織炎癥壞死及纖維化程度[16-17],提示公因子1可解釋為肝纖維化因子;AST、ALT和ALP反映肝細(xì)胞損傷程度[18],提示公因子2可解釋為肝細(xì)胞損傷因子。根據(jù)因子分析模型,大黃總蒽醌和總鞣質(zhì)對(duì)正常和肝損傷大鼠的作用規(guī)律見圖2。
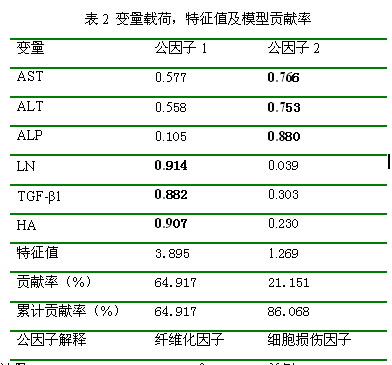
注:KMO統(tǒng)計(jì)量=0.567>0.5,Bartlett's Test χ2=97.479,單側(cè)P<0.0001
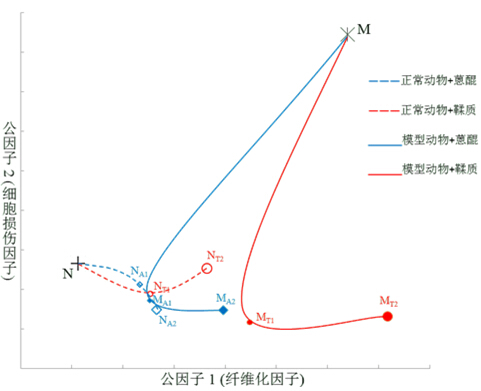
圖2 大黃蒽醌與鞣質(zhì)部位量-效/毒關(guān)系變化的因子荷載圖
4. 討論
本文在可比劑量下,對(duì)比了大黃蒽醌和鞣質(zhì)類成分對(duì)肝臟的作用規(guī)律,綜合生化和病理結(jié)果表明:(1)大黃總蒽醌對(duì)肝損傷大鼠有顯著的治療效果,具體表現(xiàn)為顯著降低血清ALT、AST、ALP,同時(shí)顯著改善了肝組織壞死和炎癥,與炎癥和纖維化有關(guān)的血清HA和TGF-β1也顯著降低。對(duì)比不同劑量組可見,蒽醌低劑量組療效比高劑量組好,提示大黃蒽醌治療肝病應(yīng)注意選擇合適的劑量。(2)與可比劑量的總蒽醌相比,大黃總鞣質(zhì)對(duì)肝損傷大鼠治療效果較差,表現(xiàn)為肝組織病理學(xué)改善不明顯,對(duì)AST、HA、LN和TGF-β1的改善效果顯著低于可比劑量的總蒽醌組。對(duì)比不同劑量組可見,鞣質(zhì)高劑量組療效比低劑量組差,肝組織病理表現(xiàn)甚至比模型動(dòng)物對(duì)照組更差。(3)大黃總蒽醌對(duì)正常大鼠肝臟功能和組織病理學(xué)基本沒(méi)有影響,而高劑量大黃總鞣質(zhì)可引起正常動(dòng)物ALT、AST、HA、LN和TGF-β1顯著升高,肝組織病理檢查可見顯著損傷,提示大黃鞣質(zhì)對(duì)肝臟的損傷作用大于蒽醌。
為了進(jìn)一步綜合且直觀地展現(xiàn)大黃蒽醌和鞣質(zhì)對(duì)正常和肝損傷大鼠的作用規(guī)律,采用因子分析方法提取了生化指標(biāo)的2個(gè)公因子:公因子1(肝纖維化因子)和公因子2(肝細(xì)胞損傷因子)。從公因子變化軌跡(圖2)可以直觀看出大黃蒽醌和鞣質(zhì)對(duì)肝臟的量-效/毒關(guān)系變化趨勢(shì):(1)與N組相比,大黃總鞣質(zhì)隨劑量增加,沿著纖維化方向與細(xì)胞損傷方向逐漸偏離,以纖維化方向明顯,說(shuō)明大黃鞣質(zhì)會(huì)影響正常大鼠的肝功能。(2)與M組相比,在肝細(xì)胞損傷因子方向,大黃總鞣質(zhì)不同程度地促進(jìn)了細(xì)胞損傷恢復(fù),而在肝纖維化因子方向,低劑量大黃鞣質(zhì)有一定的抗纖維化作用,高劑量卻進(jìn)一步加重了模型動(dòng)物的肝纖維化程度,提示鞣質(zhì)類成分是大黃肝損傷作用的主要物質(zhì)。(3)與鞣質(zhì)給藥組相比,正常動(dòng)物給予大黃蒽醌后,無(wú)論在細(xì)胞損傷因子還是纖維化因子都表現(xiàn)出更低的損傷作用。模型動(dòng)物給予蒽醌后,在細(xì)胞損傷因子方向明顯促進(jìn)了細(xì)胞損傷恢復(fù),在肝纖維化因子方向也表現(xiàn)出明顯的抗纖維化作用,提示蒽醌類成分是大黃保肝作用的主要物質(zhì)。
文獻(xiàn)報(bào)道大黃蒽醌類成分可以阻斷實(shí)驗(yàn)動(dòng)物組織纖維化進(jìn)程[19,20]。肝纖維化是由各種致病因子所致肝內(nèi)結(jié)締組織異常增生,導(dǎo)致肝內(nèi)纖維性細(xì)胞外基質(zhì)(fibrillar extracellular matrix, ECM)過(guò)度沉積的病理過(guò)程。肝星型細(xì)胞(hepatic stellate cell, HSC)的激活與細(xì)胞外基質(zhì)成分(ECM)生成過(guò)多和降解不足是肝纖維化形成的主要環(huán)節(jié)[21]。TGF-β1能激活HSC,促進(jìn)激活的HSC存活,刺激HSC轉(zhuǎn)化、增值和合成ECM,同時(shí)抑制ECM的降解,導(dǎo)致肝纖維化,ECM是已知最強(qiáng)的促進(jìn)肝纖維化細(xì)胞因子[22,23]。正常的肝細(xì)胞無(wú)TGF-β1的表達(dá),一旦肝臟受損,血小板、巨噬細(xì)胞、庫(kù)普弗細(xì)胞等激活后釋放出TGF-β1。大黃素和大黃酸等蒽醌類物質(zhì)能夠抑制TGF-β1的表達(dá),從而抑制HSC的活化,阻止肝纖維化的發(fā)生[24,25],推測(cè)是大黃保肝作用的重要機(jī)制。
鞣質(zhì)又稱單寧,是一類比較復(fù)雜的多元酚類化合物,分為可水解鞣質(zhì)和縮合鞣質(zhì)兩大類[26]。鞣質(zhì)的肝毒性多有報(bào)道,但研究較為薄弱,一般認(rèn)為可水解鞣質(zhì)的肝毒性較大。大黃鞣質(zhì)主要為可水解鞣質(zhì)類。本實(shí)驗(yàn)結(jié)果顯示,高劑量大黃鞣質(zhì)可引起肝損傷,且主要是沿著纖維化方向發(fā)展。大黃鞣質(zhì)肝毒性研究較少,應(yīng)引起關(guān)注深入研究并闡明其誘發(fā)肝纖維化損傷的分子機(jī)制。大黃鞣質(zhì)主要是由沒(méi)食子酸和兒茶素為基本單元結(jié)合或縮合形成的系列衍生物,一般認(rèn)為沒(méi)食子酸的肝毒性大于兒茶素,大黃鞣質(zhì)的主要毒性成分及構(gòu)-毒關(guān)系需要深入研究。
蒽醌和鞣質(zhì)是大黃中最重要的兩類活性成分。本文結(jié)果提示在一定的劑量范圍,大黃蒽醌和鞣質(zhì)對(duì)肝臟表現(xiàn)出相反的作用,蒽醌保肝、鞣質(zhì)傷肝;而筆者課題組前期研究還發(fā)現(xiàn),大黃蒽醌和鞣質(zhì)對(duì)胃腸道也具有相反的作用,蒽醌致瀉、鞣質(zhì)止瀉 [27],說(shuō)明大黃具有雙向作用的特點(diǎn)。由于組成成分復(fù)雜,很多中藥都存在雙向作用[28],如人參既能升壓又能降壓[29],人參所含不同皂苷類成分表現(xiàn)出促進(jìn)血管生成和抑制血管生成的相反作用[30],三七能止血又能活血[31]等。有學(xué)者將中藥的雙向作用稱為陰陽(yáng)作用[9,30]。本文采用因子分析方法,直觀反映出了大黃蒽醌與鞣質(zhì)對(duì)肝臟的陰/陽(yáng)矛盾作用,為研究大黃的效/毒雙向作用提供了有益參考。
筆者前期研究大黃總提物對(duì)肝臟的雙向作用發(fā)現(xiàn)[13],大黃在一定劑量下對(duì)正常動(dòng)物表現(xiàn)出肝損傷作用,但對(duì)于肝損傷模型動(dòng)物則表現(xiàn)出治療作用,符合《黃帝內(nèi)經(jīng)》“有故無(wú)殞”思想對(duì)藥物毒性作用的認(rèn)識(shí),即是指當(dāng)藥物選擇對(duì)證(病),不僅不會(huì)發(fā)生毒性作用,還可以有效治療疾病[32],但該研究未設(shè)計(jì)實(shí)驗(yàn)探討大黃“有故無(wú)殞”現(xiàn)象的物質(zhì)基礎(chǔ)。本實(shí)驗(yàn)在“有故無(wú)殞”思想指導(dǎo)下,采用肝損傷模型動(dòng)物與正常動(dòng)物對(duì)比考察大黃致肝損傷的化學(xué)成分,發(fā)現(xiàn)大黃總鞣質(zhì)提取物是引起大鼠肝損傷的主要成分,總蒽醌提取物是肝保護(hù)作用的主要成分。與前期大黃總提物的實(shí)驗(yàn)比較[13],將大黃鞣質(zhì)和蒽醌分開后,大黃鞣質(zhì)引起大鼠肝損傷所需的用藥周期比大黃總提物更短、且損傷更明顯,推測(cè)原因可能是總提物中蒽醌成分的肝保護(hù)作用拮抗了鞣質(zhì)成分的肝損傷作用。因此大黃在臨床治療肝病時(shí),應(yīng)注意設(shè)法減少對(duì)鞣質(zhì)成分的煎出和提取,避免鞣質(zhì)類成分對(duì)療效的影響和潛在的肝毒性。中藥不同組分間拮抗作用對(duì)臨床療效和安全性可能產(chǎn)生的影響尚未得到充分重視,應(yīng)加強(qiáng)研究,提高中藥臨床合理用藥水平。
參考文獻(xiàn)
[1] 國(guó)家藥典委員會(huì). 中華人民共和國(guó)藥典2010 年版[M]. 一部. 北京:中國(guó)醫(yī)藥科技出版社,2010: 22.
[2] W.Y.Wen, J.Ouyang, X.H.Xiao,et al. Antimicrobial properties and toxicity of anthraquinones by microcalorimetric bioassay[J]. Chinese Journal of Chemistry, 2006,24(1):45-50.
[3]任紅兵,王艷艷,王團(tuán)結(jié).大黃總蒽醌對(duì)大鼠急性腎毒性研究[J]. 遼寧中醫(yī)藥大學(xué)學(xué)報(bào), 2012,14(1):69-71.
[4]笪紅遠(yuǎn),江振洲,王翠芬,等.大黃酸和大黃素在體外對(duì)人腎小管上皮細(xì)胞的毒性作用研究[J].中草藥, 2009,40(1):102 -105.
[5]傅興圣,陳菲,劉訓(xùn)紅,等.大黃化學(xué)成分與藥理作用研究新進(jìn)展[J]. 中國(guó)新藥雜志, 2011 ,20(16):1534-1538.
[6]王伽伯, 馬永剛, 張 萍,等.炮制對(duì)大黃化學(xué)成分和肝腎毒性的影響及其典型相關(guān)分析[J].藥學(xué)學(xué)報(bào), 2009,44( 8) : 885- 890.
[7] 邢晶晶,曹婷婷,楊帆,等.鞣質(zhì)類化合物研究的進(jìn)展情況[J].黑龍江醫(yī)藥, 2011,24( 5) : 776 -780.
[8]杜國(guó)成.中藥鞣質(zhì)成分的藥理作用探析[J].中國(guó)醫(yī)藥科學(xué), 2000,17( 1) : 27-33.
[9]Ling-na Zeng,Zhi-jie Ma,Jia-bo Wang,et al. The protective and toxic effects of rhubarb tannins and anthraquinones in treating hexavalent chromium-injured rats: The Yin/Yang actions of rhubarb[J]. Journal of Hazardous Materials, 2013,246-247:1-9.
[10]孫玉琦, 肖小河, 馬永剛,等. 大黃煎煮過(guò)程中蒽醌類成分動(dòng)態(tài)變化規(guī)律研究[J]. 解放軍藥學(xué)學(xué)報(bào),2006,22(4): 281.
[11] 國(guó)家藥典委員會(huì).中華人民共和國(guó)藥典2005 年版[M].一部.北京:中國(guó)醫(yī)藥科技出版社,附錄XB“鞣質(zhì)含量測(cè)定法”.
[12]J.B. Wang, Y. Qin, W.J. Kong, et al. Identification of the antidiarrhoeal components in official rhubarb using liquid chromatography–tandem mass spectrometry[J]. Food Chemistry, 2011,129(4):1737–1743.
[13]J.B. Wang, H.P. Zhao, Y.L. Zhao, et al. Hepatotoxicity or hepatoprotection? Pattern recognition for the paradoxical effect of the Chinese herb Rheum palmatum L. in treating rat liver injury[J]. PLoS ONE, 2011, 6(9):e24498 doi:10.1371/journal.pone.0024498.
[14] Sharma S. Applied Multivariate Techniques[M]. New York: Wiley 1996,90-143.
[15] Miele L, Forgione A, La Torre G, et al. Serum levels of hyaluronic acid and tissue metalloproteinase inhibitor-1 combined with age predict the presence of nonalcoholic steatohepatitis in a pilot cohort of subjects with nonalcoholic fatty liver disease[J]. Transl Res ,2009, 154(4): 194-201.
[16] 黨雙鎖, 李亞萍. TGF-β1在纖維化研究中的新進(jìn)展[J]. 中國(guó)病理生理雜志,2007,23(12): 2405- 2409.
[17] 邵祥強(qiáng),肖華勝. 肝纖維化發(fā)病機(jī)制與臨床診斷的研究進(jìn)展[J].世界華人消化雜志, 2011,19(3):268-274.
[18]張潔,曹蕓,王之青,等. 常規(guī)生化指標(biāo)評(píng)估慢性肝功能損害的臨床應(yīng)用價(jià)值[J].胃腸病學(xué),2008,13(10) : 620 -622.
[19]Dong MX, Jia Y, Zhang YB,et al. Emodin protects rat liver from CCl4-induced fibrogenesis via inhibition of hepatic stellate cells activation[J]. World Journal of Gastroenterology , 2009, 15(38): 4753-4762 .
[20]田 瑗,郭曉琳,王麗強(qiáng),等.大黃素對(duì)TNBS誘導(dǎo)大鼠腸纖維化的影響[J].世界華人消化雜志, 2012,20(28): 2703-2708.
[21] Li JT ,et al. Molecular mechanism of hepatic stellate cell activation and antifibrotic therapeutic strategies[J]. J Gastroenterol, 2008, 43(6): 419-428.
[22]黃艷,黃成,李俊. 肝纖維化病程中Kupffer細(xì)胞分泌的細(xì)胞因子對(duì)肝星狀細(xì)胞活化增值、凋亡的調(diào)控[J]. 中國(guó)藥理學(xué)通報(bào), 2010,26(1):9-13 .
[23] Matsuoka M ,et al. Stimulation of hepatic lipocyte collagen production by Kupffer cell-derived transforming growth factor b: implication for a pathogenetic role in alcoholic liver fibrogenesis[J]. Hepatology, 1990,11(4): 599-605.
[24] 曾嶸,王儉勤,段書眾,等.大黃酸對(duì)人腎小管上皮細(xì)胞血小板反應(yīng)蛋白和TGF-β1表達(dá)的影響[J].腎臟病與透析腎移植雜志, 2008,17( 3) : 249-251.
[25]J-M Zheng, J-M Zhu, L-S Li and Z-H Liu. Rhein reverses the diabetic phenotype of mesangial cells over-expressing the glucose transporter (GLUT1) by inhibiting the hexosamine pathway[J]. British Journal of Pharmacology, 2008,153(7):1456–1464.
[26]黃浩,巢啟榮.大黃鞣質(zhì)及相關(guān)物的研究概況[J].中草藥,1997,29(3):199-202.
[27]Y. Qin, J.B. Wang, W.J. Kong, et al.The diarrhoeogenic and antidiarrhoeal bidirectional effects of rhubarb and its potential mechanism[J]. J Ethnopharmacol,2011,133(3): 1096-1102.
[28]張曉雙,白黎明.論中藥的雙向調(diào)節(jié)作用[J].甘肅中醫(yī)學(xué)院學(xué)報(bào),2006,23(4):14-15.
[29] P.Y. Yue, N.K. Mak, Y.K. Cheng, et al.Pharmacogenomics and the Yin/Yang actions of ginseng: anti-tumor, angiomodulating and steroid-like activities of ginsenosides[J]. Chinese Medicine, 2007,2:6 doi:10.1186/1749-8546-2-6.
[30]S. Sengupta, S.A. Toh, L.A. Sellers,et al. Modulating angiogenesis: the yin and the yang in ginseng[J]. Circulation,2004, 110 (10):1219-1225.
[31] T. B. Ng. Pharmacological activity of sanchi ginseng (Panax notoginseng) [J].Journal of Pharmacy and Pharmacology,2006,58:1007-1019.
[32] M. Ni, The Yellow Emperor’s Classic of Medicine: A new translation of the Neijing Suwen with commentary[M], Shambhala, Boston, 1995.
北京藥學(xué)會(huì) 地址:北京市朝陽(yáng)區(qū)北三環(huán)中路2號(hào)小二樓2層
本網(wǎng)站瀏覽46592929次
Copyright 2012 北京藥學(xué)會(huì)( 本網(wǎng)站所有內(nèi)容未經(jīng)許可,不得以任何形式進(jìn)行轉(zhuǎn)載 ) All Rights Reservered